


Next: Bibliography
Up: Chemistry in Water First
Previous: About the author
Contents
English version on the next page
Op bijna alle bladzijden van dit proefschrift staat onderaan een plaatje van
een kubische doos met moleculen. Wanneer u de pagina's snel door uw vingers laat
glijden, vormen de plaatjes een filmpje van een first principles moleculaire
dynamicasimulatie van een chemische reactie in water. Op de even genummerde pagina's
ziet u een voorbeeld van de S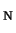 2 reactie tussen methyl chloride en een
chloor ion (welke we bestudeerden in hoofdstuk 3). Op de oneven
genummmerde pagina's laten de bewegende beeldjes een reactiepad zien van de
eerste stap van de Fenton reactie, die we bespraken in de
hoofdstukken 5 en 7.
2 reactie tussen methyl chloride en een
chloor ion (welke we bestudeerden in hoofdstuk 3). Op de oneven
genummmerde pagina's laten de bewegende beeldjes een reactiepad zien van de
eerste stap van de Fenton reactie, die we bespraken in de
hoofdstukken 5 en 7.
Even genummerde pagina's: een onrealistische S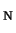 2 reactie.
In deze simulatie (zie ook het linker plaatje hieronder) manipuleerde
ik het systeem van methyl chloride en een chloor ion in waterige
oplossing zodanig dat er een reactie plaats vindt in minder dan een
halve picoseconde. Het illustreert een berucht misbruik van de zogenaamde
"constraint" methode die in de literatuur soms misleidend "method of slow-growth"
wordt genoemd. In dit geval wordt het chloor ion naar het methyl
chloride ion getrokken en tegelijkertijd word het ander chloor
weggeduwd, zonder rekening te houden met de omringende water moleculen
die zich zo snel niet kunnen aanpassen aan de veranderende situatie.
Het juiste gebruik van de constraint methode heb ik laten zien in
hoofdstuk 3.
2 reactie.
In deze simulatie (zie ook het linker plaatje hieronder) manipuleerde
ik het systeem van methyl chloride en een chloor ion in waterige
oplossing zodanig dat er een reactie plaats vindt in minder dan een
halve picoseconde. Het illustreert een berucht misbruik van de zogenaamde
"constraint" methode die in de literatuur soms misleidend "method of slow-growth"
wordt genoemd. In dit geval wordt het chloor ion naar het methyl
chloride ion getrokken en tegelijkertijd word het ander chloor
weggeduwd, zonder rekening te houden met de omringende water moleculen
die zich zo snel niet kunnen aanpassen aan de veranderende situatie.
Het juiste gebruik van de constraint methode heb ik laten zien in
hoofdstuk 3.
Oneven genummerde pagina's: een realistische Fenton reactie.
Dit filmpje laat een realistische simulatie zien van een typisch
reactiepad van de reactie tussen waterstofperoxide en een ijzer(II) ion,
oftewel de Fenton reactie. De vloeistof moleculen zijn nu slechts schematisch
weergegeven (zie ook het rechter plaatje hieronder), behalve één
water molecule dat chemisch deelneemt in de reactie. De totale duur van
de simulatie was 2.68 ps. Het filmpje begint op 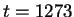 femtoseconde (fs)
op pagina 1,
alwaar de reactanten nog ruim 3 Å van elkaar gescheiden zijn.
Rond bladzijde 97 (110 fs later) breekt de zuurstof-zuurstof binding om het pentawater
ijzer(III) hydroxo intermediair te vormen en het OH. radicaal. Het
radicaal springt via het oplosmiddel water molecule naar het voorste
water ligand waarmee het reageert tot het ijzer(IV) dihydroxo intermediair
en een water molecule, ergens in de buurt van bladzijde 157 (
femtoseconde (fs)
op pagina 1,
alwaar de reactanten nog ruim 3 Å van elkaar gescheiden zijn.
Rond bladzijde 97 (110 fs later) breekt de zuurstof-zuurstof binding om het pentawater
ijzer(III) hydroxo intermediair te vormen en het OH. radicaal. Het
radicaal springt via het oplosmiddel water molecule naar het voorste
water ligand waarmee het reageert tot het ijzer(IV) dihydroxo intermediair
en een water molecule, ergens in de buurt van bladzijde 157 (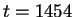 fs).
Het toenemende
zuurgehalte van het complex gedurende de reactie blijkt uit de poging tot
proton donatie van het linker waterligand aan het oplosmiddel op het eind.
Een filmpje van de tweede stap van de Fenton reactie waarbij het ferryl
ion wordt gevormd staat gepland voor de tweede druk van dit proefschrift...
fs).
Het toenemende
zuurgehalte van het complex gedurende de reactie blijkt uit de poging tot
proton donatie van het linker waterligand aan het oplosmiddel op het eind.
Een filmpje van de tweede stap van de Fenton reactie waarbij het ferryl
ion wordt gevormd staat gepland voor de tweede druk van dit proefschrift...
[width=14cm,clip=false]Figures/filmpje.eps
Most pages of this thesis contain in the lower corner a picture of a cubic box
filled with molecules. Rapidly flipping the pages will result in a motion
picture showing a trajectory of a first principles computer simulations of a
chemical reaction in aqueous solution. On the even pages, you can see an illustration
of the S 2 reaction between CH
2 reaction between CH Cl and Cl
Cl and Cl (see
chapter 3. The odd pages show the first step of the Fenton
reaction from a simulation discussed in chapter 7.
(see
chapter 3. The odd pages show the first step of the Fenton
reaction from a simulation discussed in chapter 7.
On the even pages: an unrealistic S 2 reaction.
In this simulation (see also the left-hand-side picture above) we enforced
the reaction between CH
2 reaction.
In this simulation (see also the left-hand-side picture above) we enforced
the reaction between CH Cl and Cl
Cl and Cl to occur in less than half a picosecond,
by using a constraint that simultaneously pulls the chloride ion towards the
methylene chloride carbon and pushes the other chlorine away from carbon.
It illustrates nicely a typical abuse of the method of constraint, sometimes
misleadingly called "method of slow growth". Close inspection of the movie
shows that the solvent molecules hardly change position during the enforced
reaction, because the solvent structure has no time to adapt, which leads
to an useless unphysical picture. The correct way to apply the method of constraint
was applied in chapter 3.
to occur in less than half a picosecond,
by using a constraint that simultaneously pulls the chloride ion towards the
methylene chloride carbon and pushes the other chlorine away from carbon.
It illustrates nicely a typical abuse of the method of constraint, sometimes
misleadingly called "method of slow growth". Close inspection of the movie
shows that the solvent molecules hardly change position during the enforced
reaction, because the solvent structure has no time to adapt, which leads
to an useless unphysical picture. The correct way to apply the method of constraint
was applied in chapter 3.
On the odd pages: a realistic Fenton reaction.
This movie shows a realistic simulation of a typical reaction path of the
reaction between hydrogen peroxide and an iron(II) ion, aka the Fenton reaction.
The solvent molecules are now only drawn in draft for clarity (see also the
right-hand-side snapshot above), except for one H O molecule which is
chemically involved in the reaction. The total length of the simulation was
2.68 ps. The movie starts at t=1273 femtosecond (fs) on page 1 with the reactants
still separated by 3.0 Å. Around page 97 (110 fs later), the oxygen-oxygen
bond breaks, producing the
pentaaquairon(III)hydroxo intermediate and an OH. radical. This OH.
radical jumps via the solvent water molecule to termination at the water ligand
producing the iron(IV)dihydroxo intermediate and a water molecule somewhere
close to page 157 (
O molecule which is
chemically involved in the reaction. The total length of the simulation was
2.68 ps. The movie starts at t=1273 femtosecond (fs) on page 1 with the reactants
still separated by 3.0 Å. Around page 97 (110 fs later), the oxygen-oxygen
bond breaks, producing the
pentaaquairon(III)hydroxo intermediate and an OH. radical. This OH.
radical jumps via the solvent water molecule to termination at the water ligand
producing the iron(IV)dihydroxo intermediate and a water molecule somewhere
close to page 157 (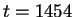 fs). The increasing acidity of the complex along
the reaction results in attempts to proton donation by the left-hand-side water
ligand in the final state. A movie of the second step, which is the barrierless
transformation of the dihydroxo intermediate into its oxo isomer, the ferryl ion,
is planned for the second edition of this thesis...
fs). The increasing acidity of the complex along
the reaction results in attempts to proton donation by the left-hand-side water
ligand in the final state. A movie of the second step, which is the barrierless
transformation of the dihydroxo intermediate into its oxo isomer, the ferryl ion,
is planned for the second edition of this thesis...



Next: Bibliography
Up: Chemistry in Water First
Previous: About the author
Contents
Bernd Ensing
2003-06-13